ALGO DE HISTORIA...
 |
| Walther Kossel imagen tomda de: http://www.100ciaquimica.net/biograf/cientif/K/kossel.htm |
En 1916, el químico alemán Walther Kossel expuso que en las reacciones químicas ocurren perdida y ganancia de electrones por parte de los átomos, y por ello estos adquieren la configuración electrónica de un gas noble. Sin duda Kossel se refería al enlace iónico, y por lo tanto a los compuestos iónicos. Posteriormente los químicos norteamericanos Gilbert Newton Lewis e Irving Langmuir, cada uno en forma independiente estudiaron los compuestos iónicos y no iónicos (covalentes), comprobando que los átomos al formar enlace químico adquieren en su mayoría la estructura atómica de un gas noble (8 electrones en el nivel externo), lo que hoy se llama Regla del Octeto.
En 1923, G.N.Lewis plantea su teoría de enlace por pares de electrones y anuncia que el octeto se logra por medio de compartición de electrones. Entonces a Kossel lo podemos considerar como el padre del enlace iónico, y a Lewis el padre del enlace covalente.
En 1926, Walter Heitler y Fritz London demostraron que el enlace covalente en la molécula de H2 se podría explicar mediante la mecánica cuántica.
La mecánica cuántica describe muy bien a los átomos y estructura electrónica de los mismos; pero la situación en la molécula es muy diferente debido a la mayor complejidad de esta, el aparato matemático es mucho mas difícil de formular y los resultados menos fáciles de obtener e interpretar.
Hoy en día, los químicos disponen de métodos de cálculo y de técnicas experimentales muy sofisticadas que permiten conocer con exactitud la forma, geometría y dimensiones de las moléculas.enlace químico(2014,20 de febrero)fullquimica recursos para profesores[http://www.fullquimica.com/2011/04/enlace-quimico.html]
CONCEPTO DE ENLACE QUÍMICO
Enlace significa unión, un enlace químico es la unión de dos o más átomos con un solo fin, alcanzar la estabilidad, tratar de parecerse al gas noble más cercano. Para la mayoría de los elementos se trata de completar ocho electrones en su último nivel. Enlace quimico (2014,20 de febrero) profesor en linea[http://www.profesorenlinea.cl/Quimica/Enlace_quimico.html]
Este vídeo te servirá para que puedas entender mejor el tema de enlace químico.
TIPOS DE ENLACE QUÍMICO
ENLACE IONICO
 |
| imagen tomada de:http://www.educarchile.cl/ech/pro/app/detalle?ID=139509 ENLACE COVALENTE |
 | ||
| imagen tomada de:http://www.educarchile.cl/ech/pro/app/detalle?ID=139509
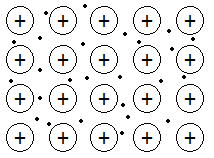
ENLACE METÁLICO
|
ENLACES INTERMOLECULARES
 |
| imagen tomada de :http://quimica2bac.wordpress.com/2010/12/09/fuerzas-intermoleculares-enlace-puente-de-hid/ |
 |
| imagen tomada de :http://www.losadhesivos.com/fuerzas-intermoleculares.html |
GENERALIDADES
Electrones de Valencia
En la mayoría de los átomos, muchos de los electrones son atraídos con tal fuerza por sus propios núcleos que no pueden interaccionar de forma apreciable con otros núcleos. Sólo los electrones que ocupan los niveles de energía más alejados del núcleo de un átomo pueden interaccionar con dos o más núcleos. A éstos se les llama electrones de valencia
Regla del octeto
Los átomos tienden a perder, ganar o compartir electrones en forma tal que queden con un total de 8 electrones en su nivel energético más exterior, esta configuración les proporciona gran estabilidad.
Estructura o Notación de Lewis
La notación o estructura de Lewis es una representación gráfica que muestra la cantidad de electrones de valencia que hay en el último orbital.
Valencia electroquímica
Se llama valencia electroquímica al número de electrones que ha perdido o ganado un átomo para transformarse en ion. Si dicho número de electrones perdidos o ganados es 1, 2, 3, etcétera, se dice que el ion (o ión) es monovalente, bivalente, trivalente, etcétera.
Iones
Los átomos están constituidos por el núcleo y la corteza (capas o niveles de energía que ocupan los electrones). El número de cargas positivas (cantidad de protones) del núcleo es igual al número de electrones que giran en la corteza; de ahí su electronegatividad (que en estado neutro es cero, y significa igual cantidad de protones a igual cantidad de electrones). Si la corteza electrónica de un átomo neutro pierde o gana electrones se forman los llamados iones.
Entonces, los iones son átomos o grupos atómicos que tienen un número mayor o menor de electrones que de protones.
En el primer caso (más electrones) los iones tienen carga negativa y reciben el nombre de aniones, y en el segundo (menos electrones) están cargados positivamente y se llaman cationes.
Elementos electropositivos y electronegativos
Se llaman elementos electropositivos aquellos que tienen tendencia a perder electrones transformándose en cationes; a ese grupo pertenecen los metales.
En cambio, elementos electronegativos son los que toman con facilidad electrones transformándose en aniones; a este grupo pertenecen los metaloides.
Los elementos más electropositivos (tendencia a perder electrones) están situados en la parte izquierda del sistema o tabla periódica; son los llamados elementos alcalinos. A medida que se avanza en cada período hacia la derecha va disminuyendo el carácter electropositivo, llegándose, finalmente, a los alógenos de fuerte carácter electronegativo (elementos con tendencia a tomar electrones).enlace químico(2014,20 de febrero)fullquimica recursos para profesores[http://www.fullquimica.com/2011/04/enlace-quimico.html]
No hay comentarios.:
Publicar un comentario