Para explicar las propiedades características de los metales (su alta conductividad eléctrica y térmica, ductilidad y maleabilidad,...) se ha elaborado un modelo de enlace metálico conocido como modelo de la nube o del mar de electrones:
Los átomos de los metales tienen pocos electrones en su última capa, por lo general 1, 2 ó 3. Estos átomos pierden fácilmente esos electrones (electrones de valencia) y se convierten en iones positivos, por ejemplo Na+, Cu2+, Mg2+. Los iones positivos resultantes se ordenan en el espacio formando la red metálica. Los electrones de valencia desprendidos de los átomos forman una nube de electrones que puede desplazarse a través de toda la red. De este modo todo el conjunto de los iones positivos del metal queda unido mediante la nube de electrones con carga negativa que los envuelve.
enlace metálico(2014,20 de febrero) enlaces[http://concurso.cnice.mec.es/cnice2005/93_iniciacion_interactiva_materia/curso/materiales/enlaces/enlaces1.htm]
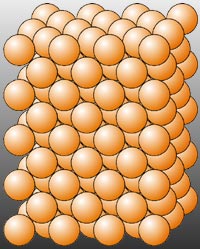 |
| Red Cristalina de Cu 2+ se hallan ordenados regularmente Imagen tomda de:http://concurso.cnice.mec.es/cnice2005/93_iniciacion_interactiva_materia/curso/materiales/enlaces/smetalicos.htm |
TEORÍA DEL MAR DE ELECTRONES
Los átomos de los metales, se encuentran rodeados por ocho o diez átomos vecinos inmediatos, esto establece el enlace metálico, a excepción de los átomos de la superficie.
En los metales los electrones están distribuidos entre los núcleos y de alguna manera se encuentran moviéndose libremente entre ellos, esto explica porque los metales son buenos conductores del calor y de la electricidad.
imagen tomada de :http://ehfdquimica.com/2013/12/25/cronicas-cientificas-de-un-viaje-a-londres/
Como resultado de sus experimentos, Sommerfeld indicaba que en los metales, los electrones se organizaban en una disposición cuántica tal que los niveles de baja energía disponibles para ellos se encuentran prácticamente ocupados.enlacemetálico(2014,20defebrero)enlaces[http://concurso.cnice.mec.es/cnice2005/93_iniciac ion_interactiva_materia/curso/materiales/enlaces/enlaces1.htm]
SÓLIDOS METÁLICOS
Sus unidades estructurales son electrones y cationes, que pueden tener cargas de +1, +2 o +3. Los cristales metálicos están formados por un conjunto ordenado de iones positivos, por ejemplo, Na+, Mg2+, Cu2+. Estos iones están anclados en su posición, como boyas en un "mar" móvil de electrones. Estos electrones no están sujetos a ningún ion positivo concreto, sino que pueden deambular a través del cristal. Esta estructura explica muchas de las propiedades características de los metales:
1. Conductividad eléctrica elevada. La presencia de un gran número de electrones móviles explica por qué los metales tienen conductividades eléctricas varios cientos de veces mayores que los no metales. La plata es el mejor conductor eléctrico pero es demasiado caro para uso normal. El cobre, con una conductividad cercana a la de la plata, es el metal utilizado habitualmente para cables eléctricos.
2. Buenos conductores del calor. El calor se transporta a través de los metales por las colisiones entre electrones, que se producen con mucha frecuencia.
3. Ductilidad y maleabilidad. La mayoría de los metales son dúctiles (capaces de ser estirados para obtener cables) y maleables (capaces de ser trabajados con martillos en láminas delgadas). En un metal, los electrones actúan como un pegamento flexible que mantiene los núcleos atómicos juntos, los cuales pueden desplazarse unos sobre otros. Como consecuencia de ello, los cristales metálicos se pueden deformar sin romperse.
4.Insolubilidad en agua y en otros disolventes comunes. Ningún metal se disuelve en agua; los electrones no pueden pasar a la disolución y los cationes no pueden disolverse por ellos mismos.enlace metálico(2014,20 de febrero) enlaces[http://concurso.cnice.mec.es/cnice2005/93_iniciacion_interactiva_materia/curso/materiales/enlaces/enlaces1.htm]

No hay comentarios.:
Publicar un comentario